Wprowadzenie
Węgiel, jeden z podstawowych pierwiastków, może istnieć w różnych strukturach znanymi jako odmiany alotropowe [od greckiego: allos (inny) i tropos (rodzaj)]. Oznacza to, że atomy węgla mogą tworzyć różne układy, prowadząc do powstania materiałów o odmiennych właściwościach fizycznych i chemicznych.
Diament
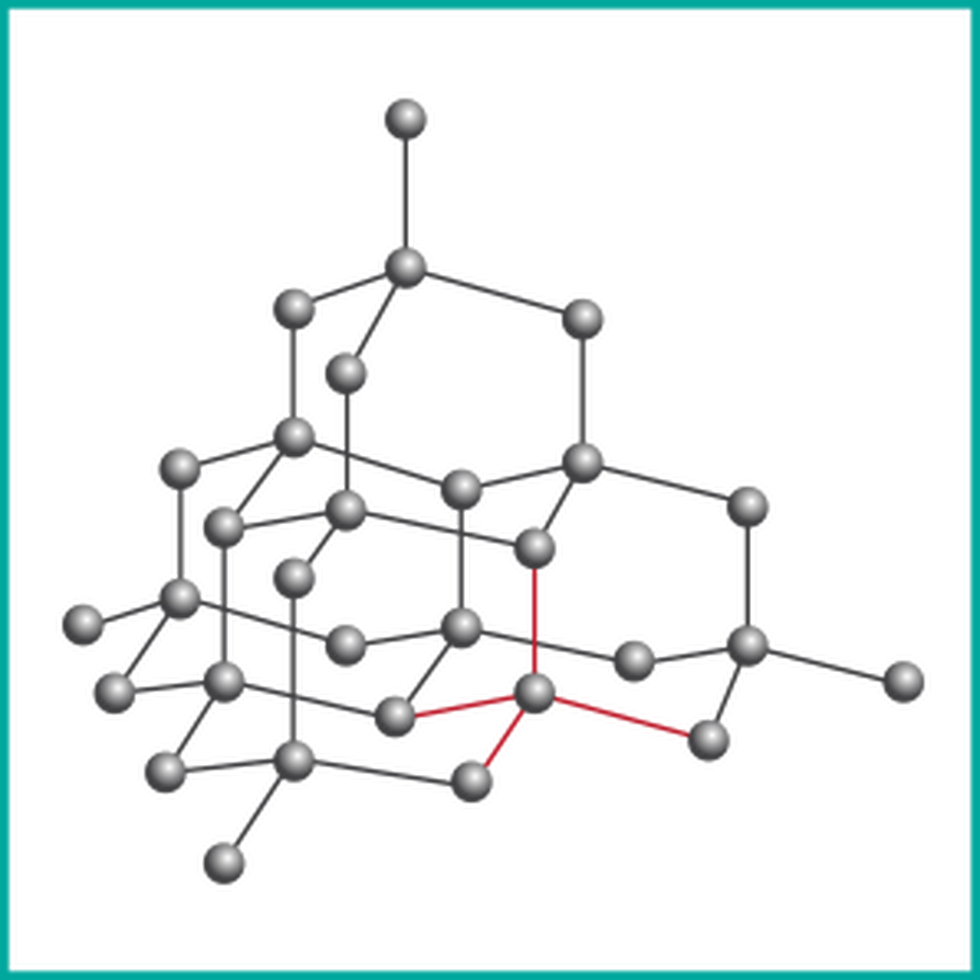
Diament jest przykładem odmiany alotropowej, w której atomy węgla tworzą trójwymiarową strukturę krystaliczną. Każdy atom węgla jest silnie połączony z czterema innymi atomami wiązaniami kowalencyjnymi, co nadaje diamentowi wyjątkowe właściwości, takie jak twardość i przezroczystość. Jest najtwardszą substancją występującą na Ziemi.
Ciekawostka: Diamenty są wykorzystywane nie tylko w jubilerstwie, ale także w przemyśle, w tym w produkcji narzędzi skrawających o dużej wytrzymałości.
Właściwości fizyczne:
- substancja stała, krucha
- zwykle bezbarwne kryształy, nierozpuszczalne w wodzie
- nie przewodzi prądu elektrycznego
- dobrze przewodzi ciepło
Właściwości chemiczne:
- bezwonny
- mało aktywny chemicznie, spala się w temperaturze wyższej od 850℃
- w podwyższonej temperaturze reaguje m.in. z F₂
Grafit
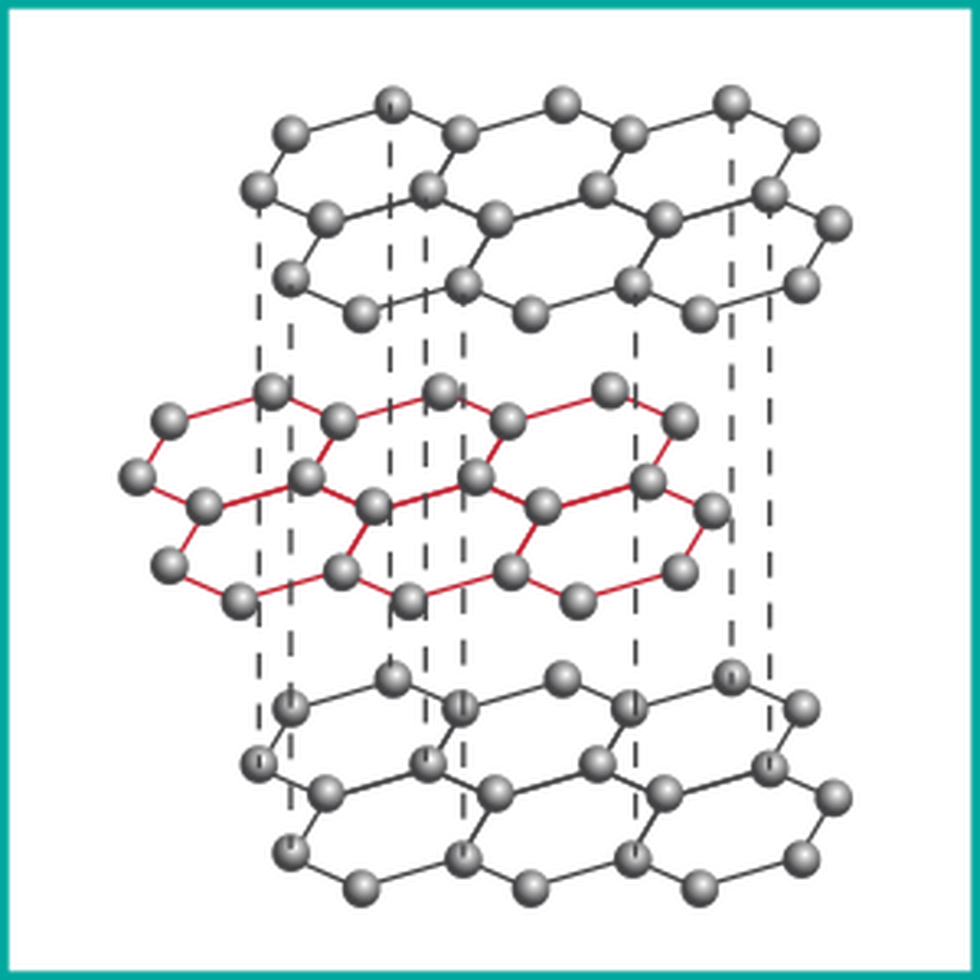
Grafit to inna odmiana alotropowa, charakteryzująca się strukturą warstwową. W tej formie atomy węgla tworzą płaskie warstwy, między którymi istnieją słabe siły przyciągania (oddziaływania van der Waalsa). To sprawia, że warstwy mogą przesuwać się względem siebie, nadając grafitowi właściwości smarne.
Ciekawostka: Grafit jest wykorzystywany w produkcji ołówków, gdzie warstwy grafenu na kartce papieru pozostawiają ślady, a nie ścierają się tak łatwo.
Właściwości fizyczne:
- substancja stała, miękka, tłusta w dotyku
- ciemnoszare płytki, nierozpuszczalne w wodzie
- dobrze przewodzi prąd elektryczny i ciepło
Właściwości chemiczne:
- bezwonny
- mało aktywny w temperaturze 0 stopni C; w podwyższonej temperaturze reaguje m.in. z Br₂
- ulega reakcjom spalania
Fullereny

Fullereny to cząsteczki węgla zbudowane z kilku lub wielu atomów, połączonych wiązaniami kowalencyjnymi, ułożonych w formie kuli lub elipsoidy. Przykładowo, fuleren C60 składa się z 60 atomów węgla ułożonych w strukturę przypominającą piłkę do piłki nożnej. Fullereny mają unikalne właściwości chemiczne i są badane ze względu na potencjalne zastosowania w nanotechnologii i medycynie.
Ciekawostka: Fullereny są przedmiotem badań w zakresie dostarczania leków i terapii genowych ze względu na swoją strukturę i zdolność do przenikania błon biologicznych.
Właściwości fizyczne:
- substancje stałe o metalicznym połysku
- kryształy o barwie od żółtej do czerwonobrązowej
- nierozpuszczalne w wodzie, rozpuszczają się w rozpuszczalnikach organicznych
- mają właściwości nadprzewodzące i półprzewodnikowe
Właściwości chemiczne:
- bezwonne
- pod wpływem światłą ulegają rozpadowi
- reagują z najaktywniejszymi litowcami
- ulega reakcjom spalania
Grafen

Grafen to jednowarstwowy arkusz atomów węgla ułożonych w strukturę heksagonalną, przypomina budową plaster miodu. Jest niezwykle cienki, lekki, a jednocześnie bardzo wytrzymały i przewodzący prąd elektryczny. Grafen ma liczne zastosowania w elektronice, nanotechnologii i innych dziedzinach nauki. Jego historia jest związana z naszym krajem, ponieważ to właśnie polskim naukowcom zawdzięczamy opracowanie technologii przemysłowego otrzymywania tej niezwykłej substancji.
Ciekawostka: Ze względu na swoje właściwości, grafen jest badany jako potencjalny materiał do produkcji superwydajnych baterii i przewodów elektrycznych.
Właściwości fizyczne:
- substancja stała, wytrzymała mechanicznie
- przezroczysty
- nierozpuszczalny w wodzie
- dobrze przewodzi prąd elektryczny i ciepło
Właściwości chemiczne:
- bezwonny
- mało aktywny chemicznie
- w wyniku reakcji z wodorem staje się izolatorem
Cyklokarbon
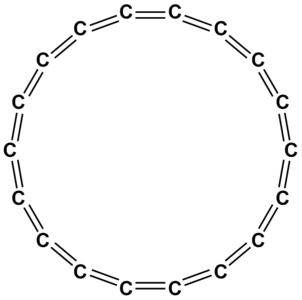
Cyklokarbon to inna interesująca odmiana alotropowa węgla. Charakteryzuje się strukturą cykliczną, a jego cząsteczki składają się z połączonych pierścieni. Jest to obszar intensywnych badań naukowych związanych z nanotechnologią.
Ciekawostka: Struktura cyklokarbonu czyni go materiałem o potencjalnych zastosowaniach w nowoczesnych technologiach, takich jak nanoelektronika.